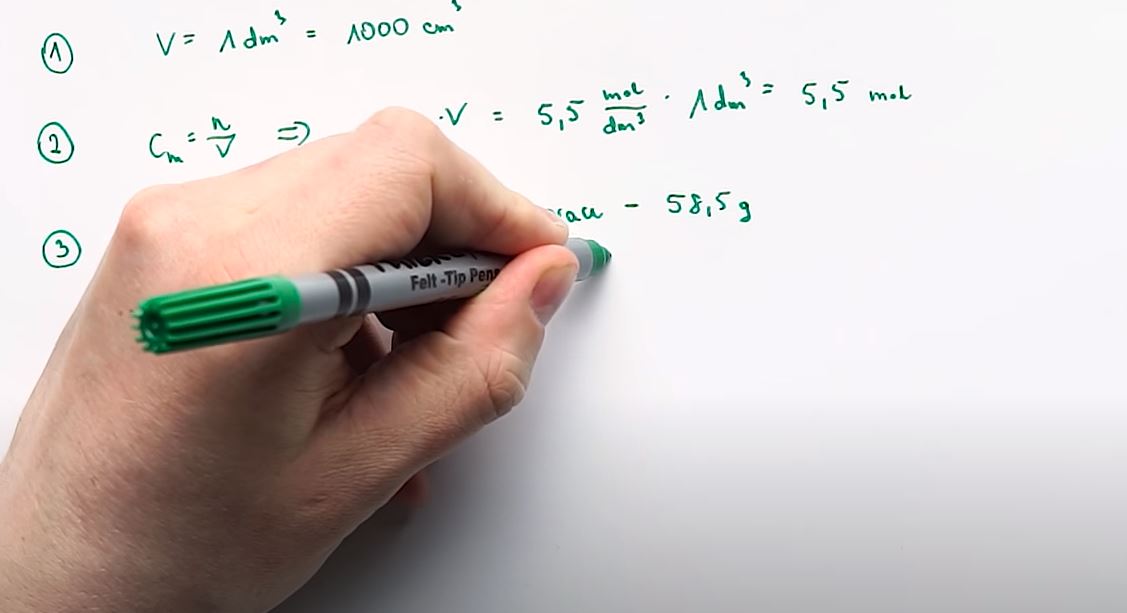
Obliczanie rozpuszczalności na podstawie stężenia nasyconego roztworu
W treściach wielu zadań dotyczących stężeń roztworów można napotkać termin: rozpuszczalność. Choć jest to termin znany maturzystom z gimnazjum (bądź szkoły podstawowej) to w zadaniach na poziomie szkoły średniej zagadnienie rozpuszczalności może już przysparzać trochę kłopotów. W tym wpisie pokażę, krok po kroku, jak obliczyć rozpuszczalność soli jeśli znamy stężenie oraz gęstość jej nasyconego roztworu. Przypomnijmy: rozpuszczalność to ilość substancji jaką można maksymalnie rozpuścić w 100 g rozpuszczalnika w danej temperaturze. Gdybyśmy taką właśnie ilość rozpuścili w 100 g rozpuszczalnika w danej temperaturze to otrzymalibyśmy roztwór nasycony, czyli taki w którym nie można rozpuścić już więcej substancji w danej temperaturze. Dlaczego na każdym kroku używamy określenia “w danej temperaturze”? Ponieważ rozpuszczalność zależy od temperatury i dla większości substancji zmienia się wraz ze zmianą temperatury. Tyle tytułem wstępu, przejdźmy do zadania i jego rozwiązania krok po kroku.
Dokładne omówienie rozpuszczalności substancji, stężeń roztworów oraz stechiometrii chemicznej znajdziesz w kursie 3 dotyczącym mola, stechiometrii chemicznej, stężeń i rozpuszczalności. Link znajdziesz tutaj.
Oblicz rozpuszczalność NaCl jeśli w temperaturze 20°C nasycony roztwór tej soli ma stężenie $5,5\ mol·dm^{-3}$ i gęstość $1,2\ g·cm^{-3}$.
Zanim przejdziemy do rozwiązania…
…chciałbym zaprosić Cię do sprawdzenia moich kursów online, które pomogą Ci przygotować się do sprawdzianów i matury z chemii. Zawierają one ponad 54 godziny lekcji w formie wideo, z których każdego roku korzysta kilkuset uczniów.
Dowiedz się więcej o kursachRozwiązanie zadania:
W rozwiązaniu zadania z obliczaniem rozpuszczalności soli można wyróżnić 5 etapów.
Etap 1 – Zakładamy objętość roztworu
Rozwiązywanie zadania rozpoczniemy od założenia pewnej objętości roztworu. W treści zadania nie mamy informacji, ile było roztworu, znamy jedynie jego gęstość i stężenie molowe. Ponieważ zarówno gęstość jak i stężenie molowe nie zależą od objętości roztworu to nie musiała ona zostać podana, a my możemy przyjąć dowolne założenie. Najprościej będzie przyjąć, że dysponujemy 1 dm3 roztworu, czyli 1000 cm3. W dalszej części zobaczysz, dlaczego jest to dobry wybór 🙂
Etap 2 – Obliczamy liczbę moli soli w roztworze
Na drugim etapie wykorzystujemy jedną z danych z treści zadania: stężenie molowe nasyconego roztworu. Znając stężenie molowe i objętość (którą założyliśmy na etapie 1) możemy wyznaczyć liczbę moli soli w roztworze o przyjętej objętości. Po przekształceniu wzoru na stężenie molowe otrzymujemy: n = c · V. Po podstawieniu danych wraz z jednostkami otrzymujemy: \[n=5,5\ mol·dm^{-3}·1\ dm^3=5,5\ mol \] Jak widać obliczenia te nie wymagają użycia kalkulatora, ponieważ przyjęliśmy objętość roztworu 1 dm3. Wpływa to niewątpliwie na czas rozwiązania takiego zadania, bo przyjmując mniej wygodną liczbę jako objętość np. 0,25 dm3 musimy już najczęściej użyć kalkulatora.
Etap 3 – Obliczamy masę soli w roztworze
Znając liczbę moli soli w roztworze obliczamy masę soli w roztworze. Wykorzystujemy do tego masę molową soli obliczoną z danych zawartych w układzie okresowym. Masa molowa NaCl wynosi 58,5 g·mol-1. Układamy proporcję: \[1\ mol\ NaCl-58,5\ g \]\[ 5,5\ mol\ NaCl-x\ g \] Otrzymujemy: $x = 321,8\ g$
Można również skorzystać ze wzoru na liczbę moli. Po jego przekształceniu otrzymujemy: m = n · M. Po podstawieniu danych wraz z jednostkami otrzymujemy: \[m=5,5\ mol·58,5\ g·mol^{-1}=321,8\ g \]
Etap 4 – Obliczamy masę roztworu
Wykorzystaliśmy już informację o stężeniu molowym nasyconego roztworu. Teraz korzystamy z informacji o gęstości nasyconego roztworu. Znając objętość roztworu (którą założyliśmy na etapie 1) i korzystając ze wzoru na gęstość obliczamy masę nasyconego roztworu. Po przekształceniu wzoru na gęstość otrzymujemy: m = d · V. Po podstawieniu danych wraz z jednostkami otrzymujemy: \[m_r=1000\ cm^3·1,2\ g·cm^{-3}=1200\ g \] Również te obliczenia nie wymagają użycia kalkulatora, ponieważ przyjęliśmy objętość roztworu 1 dm3 (1000 cm3). Wystarczy zatem przesunąć przecinek o 3 miejsca w prawo 🙂
Etap 5 – Obliczamy rozpuszczalność soli
Ostatni, kluczowy etap to wyznaczenie rozpuszczalności soli. Korzystamy z masy soli zawartej w roztworze (wyliczonej na etapie 3) oraz masy nasyconego roztworu (wyliczonej na etapie 4). Odejmując od masy nasyconego roztworu masę soli zawartą w roztworze otrzymujemy masę wody. \[m_{wody}=1200\ g-321,8\ g=878,2\ g \] Masę soli, wody oraz nasyconego roztworu zestawiamy w proporcji: \[321,8\ g\ NaCl-878,2\ g\ wody-1200\ g\ roztworu \] Pozostaje już tylko przeliczyć masę NaCl przypadającą na 100 g WODY w tym roztworze. Korzystamy z utworzonej proporcji wpisując w odpowiednich miejscach dane i szukane: \[321,8\ g\ NaCl-878,2\ g\ wody-1200\ g\ roztworu \] \[ y\ g\ NaCl-100\ g\ wody……………. \] Otrzymujemy: $y = 36,6\ g$.
Jest to rozpuszczalność NaCl na 100 g wody, oczywiście w temperaturze 20°C, bo w tej temperaturze roztwór NaCl o stężeniu 5,5 mol·dm-3 i gęstości 1,2 g·cm-3 jest roztworem nasyconym.
Odpowiedź: Rozpuszczalność NaCl w temp. 20°C wynosi 36,6 g na 100 g wody.
Czy macie jakieś pytania albo uwagi? A może zauważyliście literówkę albo błąd? Piszcie w komentarzach.
PS: Dokładne omówienie tego zadania znajdziecie w Zadaniu Dnia #11 na moim kanale na YouTube:
Pobierz zbiór zadań w formacie PDF
Jeżeli przygotowujesz się do matury z chemii i szukasz przydatnych materiałów do nauki, to koniecznie sprawdź także przygotowany przeze mnie zbiór zadań maturalnych z chemii. Możesz pobrać go całkowicie za darmo w formacie PDF.
Sprawdź zbiór zadań

