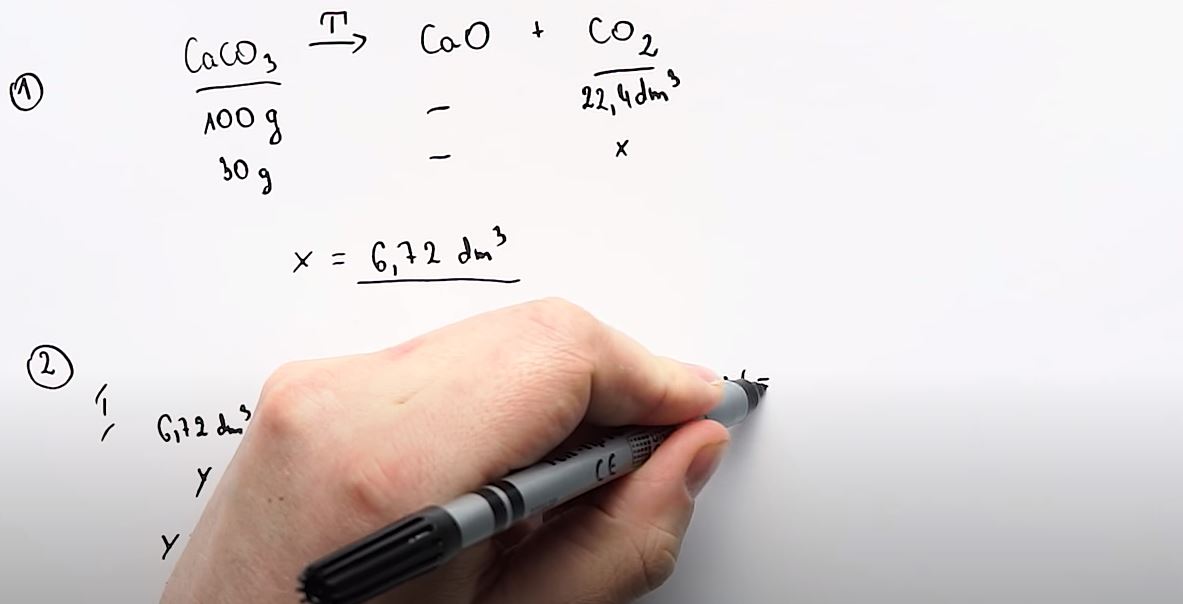
Wydajność reakcji: obliczanie ilości produktu
Rozwiązywanie zadań, w treści których pojawia się hasło: wydajność reakcji chemicznej nierzadko stanowi spore wyzwanie dla przyszłych maturzystów. Z drugiej strony obliczenia związane z wydajnością reakcji zaliczają się do podstaw chemii ogólnej. W tym wpisie pokażę jak, krok po kroku, rozwiązać kolejny z trzech typów zadań związanych z wydajnością. Przykładowe zadanie wraz z rozwiązaniem poniżej.
Oblicz, jaką objętość zajmie w warunkach normalnych dwutlenek węgla otrzymany w wyniku prażenia $30\ g$ wapienia $(CaCO_3)$ jeśli wydajność reakcji wynosi 70%.
Zanim przejdziemy do rozwiązania…
…chciałbym zaprosić Cię do sprawdzenia moich kursów online, które pomogą Ci przygotować się do sprawdzianów i matury z chemii. Zawierają one ponad 54 godziny lekcji w formie wideo, z których każdego roku korzysta kilkuset uczniów.
Dowiedz się więcej o kursachRozwiązanie zadania:
Rozwiązanie zadania z obliczaniem ilości produktu po reakcji przy określonej wydajności można podzielić na dwa etapy.
Etap 1 – Wykorzystując metodę 6 kroków obliczamy teoretyczną ilość produktu
Jako pierwszą obliczamy objętość dwutlenku węgla, który powstaje w reakcji rozkładu 30 g węglanu wapnia. Na tym etapie nie zajmujemy się wydajnością reakcji, tzn. postępujemy tak, jakby reakcja zachodziła ze 100% wydajnością. Możemy, na przykład, skorzystać z “metody 6 kroków”. Dokładnie omawiam ją w kursie 3 dotyczącym mola i stechiometrii. Link znajdziesz tutaj.
Krok 1. Zapisujemy równanie zachodzącej reakcji chemicznej.
W tym zadaniu mowa jest o rozkładzie wapienia pod wpływem temperatury. \[CaCO_3 \xrightarrow{T} CaO+CO_2 \]
Warto zaznaczyć, że w większości obecnie pojawiających się na egzaminach zadań równania zachodzących reakcji chemicznych są podane w treści zadania lub w informacji wstępnej. Jednak reakcja rozkładu wapienia pod wpływem temperatury jest prosta i każdy maturzysta powinien ją doskonale znać. Dlatego jej brak w treści zadania nie powinien nikogo martwić.Krok 2. Dobieramy współczynniki stechiometryczne.
W przypadku tej reakcji współczynniki się zgadzają. \[CaCO_3 \xrightarrow{T} CaO+CO_2 \]
Krok 3. Podkreślamy istotne reagenty.
W tym zadaniu mowa o 30 g wapienia oraz objętości dwutlenku węgla. \[ \underline{CaCO_3} \xrightarrow{T} CaO+ \underline{CO_2} \]
Krok 4. Wybieramy jednostki dla podkreślonych reagentów.
Następnie dla podkreślonych reagentów wybieramy i zapisujemy jednostki. Dla wapienia będzie to jednostka $masy\ (g)$, ponieważ w zadaniu jest informacja o 30 g wapienia. W przypadku dwutlenku węgla mamy do czynienia z gazem będącym w warunkach normalnych. Dlatego wybieramy jednostkę $dm^3$. \[ \underset{g}{\underline{CaCO_3}} \xrightarrow{T} CaO+ \underset{dm^3}{\underline{CO_2}} \]
Krok 5. Zapisujemy dane teoretyczne wynikające z układu okresowego oraz naszej wiedzy.
Kolejny krok to zapisanie danych wynikających ze stechiometrii reakcji oraz układu okresowego. W równaniu reakcji występuje 1 mol wapienia. Masa jednego mola $CaCO_3$ z układu okresowego to $100\ g$. W równaniu występuje również jeden mol $CO_2$. Jak pamiętamy 1 mol każdego gazu (doskonałego) w warunkach normalnych zajmuje objętość $22,4\ dm^3$, dlatego taką wartość wpisujemy. \[ \underset{100\ g}{\underline{CaCO_3}} \xrightarrow{T} CaO+ \underset{22,4\ dm^3}{\underline{CO_2}} \]
Krok 6. Zapisujemy dane z zadania i niewiadomą.
Ostatni krok to wykorzystanie informacji z polecenia. Zgodnie z treścią zadania dysponujemy 30 g wapienia. Objętość dwutlenku węgla chcemy obliczyć, dlatego tam pojawia się niewiadoma, na przykład “x”. \[ \underset{30\ g}{\underset{100\ g}{\underline{CaCO_3}}} \xrightarrow{T} CaO+ \underset{x\ dm^3}{\underset{22,4\ dm^3}{\underline{CO_2}}} \] Otrzymujemy: $x = 6,72\ dm^3$.
Etap 2 – Obliczamy rzeczywistą ilość produktu
Na drugim etapie wykorzystujemy informację o wydajności reakcji. Jeśli wydajność nie wynosi 100% to znaczy, że produktu powstaje mniej niż wynika to ze stechiometrii. Ponieważ w omawianym zadaniu wydajność wynosi 70%, układamy następującą proporcję: \[6,72\ dm^3-100\% \]\[ y\ dm^3-70\% \] Otrzymujemy: $y = 4,7\ dm^3$.
Odpowiedź: Otrzymany dwutlenek węgla zajmie objętość 4,7 dm3.
Czy macie jakieś pytania albo uwagi? A może zauważyliście literówkę albo błąd? Piszcie w komentarzach.
PS: Dokładne omówienie tego zadania znajdziecie w Zadaniu Dnia #12 na moim kanale na YouTube:
Pobierz zbiór zadań w formacie PDF
Jeżeli przygotowujesz się do matury z chemii i szukasz przydatnych materiałów do nauki, to koniecznie sprawdź także przygotowany przeze mnie zbiór zadań maturalnych z chemii. Możesz pobrać go całkowicie za darmo w formacie PDF.
Sprawdź zbiór zadań

